当前位置:疾病要闻正文
千乘镜像 | 阿尔茨海默病的挑战和希望

2022年5月13日上海绿谷制药有限公司官方微信公众号宣布,受融资未到位及疫情导致临床研究质量风险和研究成本逐步增加等影响,决定提前终止于2020年4月获得美国食药监局FDA批准的用于阿尔茨海默病(Alzheimer's disease,AD)的甘露特钠胶囊(GV-971,商品名:九期一)国际多中心Ⅲ期临床试验。这款自附条件在国内上市后一直备受争议的阿尔茨海默病新药再次吸引了大众的眼球,而人们对阿尔茨海默病新药研发的前景愈发悲观。近20年来,仅两款阿尔茨海默病新药获批上市,除在国内附条件获批上市的绿谷制药九期一外,还有Biogen(渤健)/日本卫材的AD药物阿杜卡奴单抗(商品名:Aduhelm)。渤健的Aduhelm是近20年来首个被FDA批准上市的治疗AD药物。同样是在一片争议声中,上市后的Aduhelm销售业绩惨淡,且在“美国医保”报销上收到严格限制。
在如今全球每年新增百万AD病例、治疗药物需求迫切的情况下,当今科学界、医疗服务和制药行业面临的主要挑战是:
· 加深对AD主要病因及其致病机制的理解
· 确定和开发能够减缓或停止疾病进程的新药和治疗策略
· 对可靠的生物标志物进行表征和验证,以便进行早期诊断
· 在最佳条件下,制定新的预防方案,能够阻止处于症状前阶段的高危人群中疾病的发展
本文简要分析迄今为止AD药物研发的成功与失败,并重点介绍了新的药物替代疗法,这些技术可能会促进对AD病理生理学的深层次理解,从而进行更有效的AD诊断和治疗。

AD的典型组织病理学特征是Aβ的异常沉积(斑块)和tau蛋白的神经原纤维缠结,因此,tau和Aβ已成为AD药物开发的主要靶点。Aβ是一种长度不等的肽(主要是Aβ42 和 Aβ40),由淀粉样前体蛋白(APP)蛋白水解产生。APP由两种膜相关酶依次切割,即β位点APP切割酶1(BACE1,或β-分泌酶)和γ-分泌酶,后者为一种以早老素-1 (PSEN1) 作为其催化结构域的多结构域蛋白。AD脑内Aβ斑块的存在导致了淀粉样级联假说,该假说直接将聚集的Aβ的累积与疾病联系起来。Aβ 的细胞毒性已在许多体内和体外研究中得到证实,并且已鉴定出Aβ寡聚体作为主要毒性物质。在AD的大脑中发现了N端截短和焦谷氨酰胺基化(Glu3或 Glu11)的Aβ肽(pEAβ),其占总Aβ的10%到50%,并且这些肽已被证明具有增强的细胞毒性。此外,PSEN1、PSEN2和APP基因中的一组致病性突变,包括Aβ编码序列中的突变,与早发性AD相关,早发性AD影响60岁以下的人群,约占所有AD病例的5%。
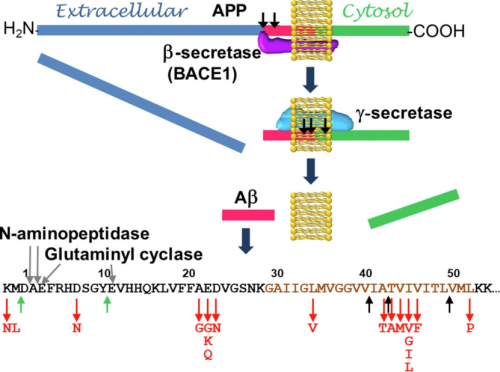
β-分泌酶和γ-分泌酶处理APP的示意图
Aβ细胞毒性的分子机制非常复杂,并且还没有完全清晰。细胞离子稳态失调是目前比较明确的机制之一,主要是调节细胞膜谷氨酸能、胆碱能和其他离子通道,或者通过与内质网的ryanodine受体Ca2+通道相互作用,导致Ca2+过度转移到线粒体,引发凋亡。此外,Aβ二聚体与谷氨酸受体的竞争性相互作用可抑制神经元对谷氨酸的摄取,从而导致神经元的高兴奋性。另一个重要机制是ROS生成过多对神经元造成氧化损伤,线粒体钙浓度升高,随后出现超氧化物介导的线粒体变性。Aβ和tau毒性由小胶质细胞和星形胶质细胞通过神经免疫调节介导。Aβ和tau的细胞外聚集体引起小胶质细胞的激活和炎症细胞因子的释放,如白细胞介素和肿瘤坏死因子α(TNFα)。这些变化为神经炎症的恶性循环奠定了基础,即星形胶质细胞的激活、活性氧和基质金属蛋白酶的分泌,导致更多Aβ和tau的产生以及神经变性,并通过反应性小胶质细胞增生和星形胶质细胞增生加速神经元和突触的丢失。
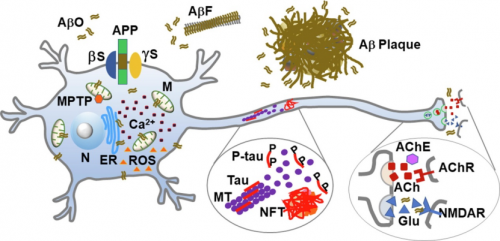
阿尔茨海默病(AD)神经病理通路示意图

在400多项AD临床试验中,超过30种AD候选药物进入到III期临床,但只有一种(aducanumab)成功获批。AD是药物开发成功率最低的疾病之一,99%的候选药物在没有临床疗效后被停用。这些失败导致很多制药公司(如辉瑞)完全放弃了AD研究,而其他公司(礼来、默克、强生)则终止了对某些类型药物的研究,如β-分泌酶抑制剂。尽管如此,目前正在进行的AD治疗或预防试验约有140项,涉及约120种药物。
如果Aβ确实在AD中起着核心作用,为什么大多数Aβ靶向的药物都失败了?造成这一令人费解结果的原因是多方面的,包括Aβ的基因组镶嵌和结构多态性、显著的症状前神经元和突触损伤、误诊、临床试验设计和分析不完善,以及与大分子量生物制剂(如单克隆抗体)外显率低相关的问题。一些AD候选药物,如BACE-1抑制剂维鲁贝西他,不仅不能减缓轻度至中度AD患者的神经病理变化,也不能减缓AD早期Aβ累积患者的神经病理变化。
单克隆抗体穿过血脑屏障并在脑组织中达到其靶点的能力很差,极大地限制了其功效。然而,可以剂量依赖性减少Aβ沉积的抗体,如阿杜单抗,会破坏BBB,带来血管源性水肿和脑微出血等副作用。BACE1或PSEN1抑制剂可能通过抑制对细胞功能和稳态至关重要的其他酶而导致严重的副作用。此外,γ-分泌酶抑制剂avagacestat和semagacestat缺乏特异性,可能导致皮肤癌风险增加。GSK-3β抑制剂失效的潜在原因是多方面的。
准确评估参与者的初始认知状态和神经病理学是临床试验中的一个重要因素。在依据临床症状被诊断患有不同阶段AD的受试者中,高达30%的人被误诊,因为受试者死后的大脑样本缺乏Aβ病理学证据。

虽然有效的AD药物仍然是数百万AD患者的梦想,一些其他非药物治疗方法也值得更积极地探索。在药物研发受阻的情况下,聚焦超声、脑深部刺激、γ振荡、反义寡核苷酸、干细胞疗法以及血液检测等技术的应用给AD的治疗带来了新的希望。
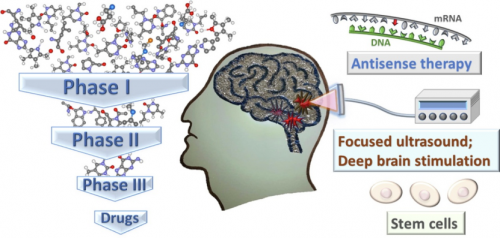
阿尔茨海默病药物现状
目前候选药物未能从I期临床试验进展到II期临床试验,再到III期临床试验,再到获得批准上市,没有产生新的疾病治疗药物,可用药物的数量十分有限,AD新药领域情况欠佳。然而,最近一些替代方法的成功给预防或治疗AD和其他神经退行性病变带来了新的希望。
磁共振引导的聚焦超声已成为治疗各种脑部疾病(包括AD)的无创手术工具。在对AD患者进行的I期安全性试验中,聚焦超声可以控制BBB开放,并减少Aβ和tau病变。一项针对6名早期AD患者的II期试验可逆地打开了BBB,并显示海马实质强化且无不良反应。研究表明,开放BBB可显著促进静脉注射治疗药物(如免疫球蛋白)向淀粉样变小鼠模型的靶向传递,并显著减少淀粉样斑块病理,增加海马神经发生。然而,超过阈值的 BBB 破坏是有害的,其与 AD 治疗中最常见的不良事件血管源性水肿和微出血直接相关。减轻 mAb 的双刃剑效应的一种方法是以受控方式打开 BBB。为此,除了聚焦超声外,还可以使用高渗溶质和激光间质热疗。利用BBB受体介导的转运系统是将单克隆抗体或神经营养素运送到大脑的另一种方法。这里,具有特定脑靶点(如Aβ)的单克隆抗体与另一种抗体共价或非共价结合,该抗体与BBB受体(如转铁蛋白受体)具有亲和力,允许静脉注射的双特异性结合物穿过BBB并通过转胞作用到达脑。其他BBB迂回方法,如直接向脑组织注射药物或经鼻给药,也曾尝试过,但未能成功。
其他治疗AD的手术策略如脑深部刺激(DBS),即通过植入电极对目标大脑区域进行电刺激,是一种经批准的治疗帕金森病(PD)和其他一些神经疾病的方法,目前寻求批准这种治疗AD方法的临床试验正在进行中。一名肥胖患者经下丘脑刺激后记忆得以恢复,这提示了使用DBS治疗AD的可能性。此后,对轻度至重度AD患者进行了大约15次DBS临床试验,结果表明,DBS改善了认知和记忆,提高了情感和社会表现。目前正在进行的研究,包括美国的ADvance II研究,招募了210名患有轻度或可能的AD患者,目标完成日期为2024年,将提供更多关于DBS治疗AD的安全性和有效性的信息。
涉及快速脉冲抑制神经元相关的神经环路以不同频率发生振荡,其中与记忆存储和维持有关的伽马振荡以20-50Hz的频率共振。在AD小鼠模型中,通过40Hz的闪烁光刺激γ振荡,可减少海马和视觉皮层中Aβ40和Aβ42的积累。40Hz的声刺激不仅降低了小鼠的Aβ和tau病理学,而且还促进了记忆。因此,无论有无光刺激,用粉红色噪声(或1/f噪声)刺激大脑,都有望恢复AD患者的记忆。目前,法国正在进行一项涉及30名AD患者的Pink-AD概念验证临床试验。其目的是通过夜间粉红噪声治疗(ClinicalTrials.gov ID:NCT04570761)刺激大脑来改善认知和记忆。另一项目前正在进行的观察性试验AlzLife旨在测试40Hz闪烁光与认知治疗联合对认知功能的协同效应(ClinicalTrials.gov ID:NCT03657745)。
基于反义寡核苷酸的技术也正在兴起用于治疗神经退行性变。反义药物HTTRx是一种DNA寡核苷酸,与疾病相关突变mRNA结合,从而促进内源性RNase对其的降解,在涉及46名亨廷顿病患者的I/IIa期试验中证明是成功的。约5%的AD病例是与APP或Aβ产生酶的遗传或散发突变相关的早发性疾病,而更普遍的晚发性AD与APOEε4相关,因此反义疗法有望治疗AD以及其他神经退行性疾病。阻断APOEε4需要预防措施,尤其是在纯合子参与者中,避免ApoE功能完全丧失。最近,在一项Ib期临床试验中,反义疗法被应用于阻断tau的产生。这种名为BIIB080的反义寡核苷酸以剂量依赖性的方式使总tau和P-tau减少35–50%,没有严重的不良反应。该药物的疗效将在进一步的试验中进行评估。
多能干细胞(PSC)疗法在治疗帕金森病方面显示出良好的前景。这种方法是否适用于AD尚不清楚。间充质干细胞(MSCs)能够分化为多种细胞类型,包括神经元,目前正在进行的临床试验旨在利用这些细胞治疗神经退行性变。一项关于AD小鼠模型的临床前研究表明,脑室内植入骨髓间充质干细胞可增强淀粉样斑块的清除,减少神经细胞死亡,改善认知能力。因此,促进神经发生的策略,如干细胞植入,有可能成为AD和其他痴呆症的有力疗法。
最近的研究表明,AD患者血液中的主要AD生物标志物在疾病早期发生了显著变化。对Aβ42和Aβ40相对含量的血液分析证明,能够识别症状前,大多数认知正常个体已经发生淀粉样变性,其敏感性甚至高于PET。由血浆Aβ复合生物标记物确定的Aβ异常状态与认知正常受试者的记忆和执行功能下降相关,这与PET神经成像得出的相关性相似,进一步支持了基于血液的方法的诊断可行性。

最近的基础和临床研究为AD的生物学机制提供了大量的知识。然而,尽管在了解AD分子基础方面取得了进展,开发药物或非药物手段以预防、阻止或减缓AD的努力收效仍然甚微。积极的药物研究和临床试验,无论是成功的还是失败的,都具有巨大的价值。目前看来,应优先考虑预防或延缓神经退行性变,尤其是对易感个体,因为对进行中或晚期AD的治疗(即受损神经元和突触的恢复)确实困难。针对多靶点的联合治疗方法可能效果更好。基于现代技术的非药物方法,如无创或微创外科手术,应积极纳入抗AD治疗。此外,健康的生活方式(饮食、睡眠和锻炼)对于延缓AD症状也尤其重要。

参考文献:
1.Tatulian S A. Challengesand..hopes for.Alzheimer’s disease[J]. Drug Discovery Today, 2022
2.Cacabelos R. What have we learnt from.past failuresin. Alzheimer’s disease drug discovery?[J]. Expert Opinion on Drug Discovery, 2022, 17(4): 309-323.
文案 | 灵犀
审核 | 李迪迪 刘泽鹏




